
丨前言丨
随着总局不断发布细则文件,一致性评价这场最初被企业迟疑和观望的抢位赛已经进入火热状态。
2017年8月25日,CFDA发布《关于仿制药质量与疗效一致性评价工作有关事项的公告》,对一致性评价工作各环节进行了优化调整。根据政策要求:审评工作一般应当在受理后120个工作日内完成。以此速度,首批通过一致性评价品种即将面世。
大浪淘沙,“剩”者为王。企业可以根据自身情况,对市场需求大的主打品种、重点品种优先开展一致性评价,抢占市场份额。
丨本期分析丨
本期,药春秋(ID:bryaochunqiu)对289目录品种-硫酸氢氯吡格雷片进行调研分析,整理最新的调研数据供大家参考。据米内网《2017年度中国市场发展蓝皮书》,城市公立医院化学药用药市场份额,硫酸氢氯吡格雷片以1.18%的份额,排名第三。
国内批准文号数量:
硫酸氢氯吡格雷片25mg 国产2个
硫酸氢氯吡格雷片75mg 国产3个,进口5个
硫酸氢氯吡格雷片300mg 国产1个,进口4个
被列入289目录的是硫酸氢氯吡格雷片25mg,75mg。
丨调研数据丨
国外上市情况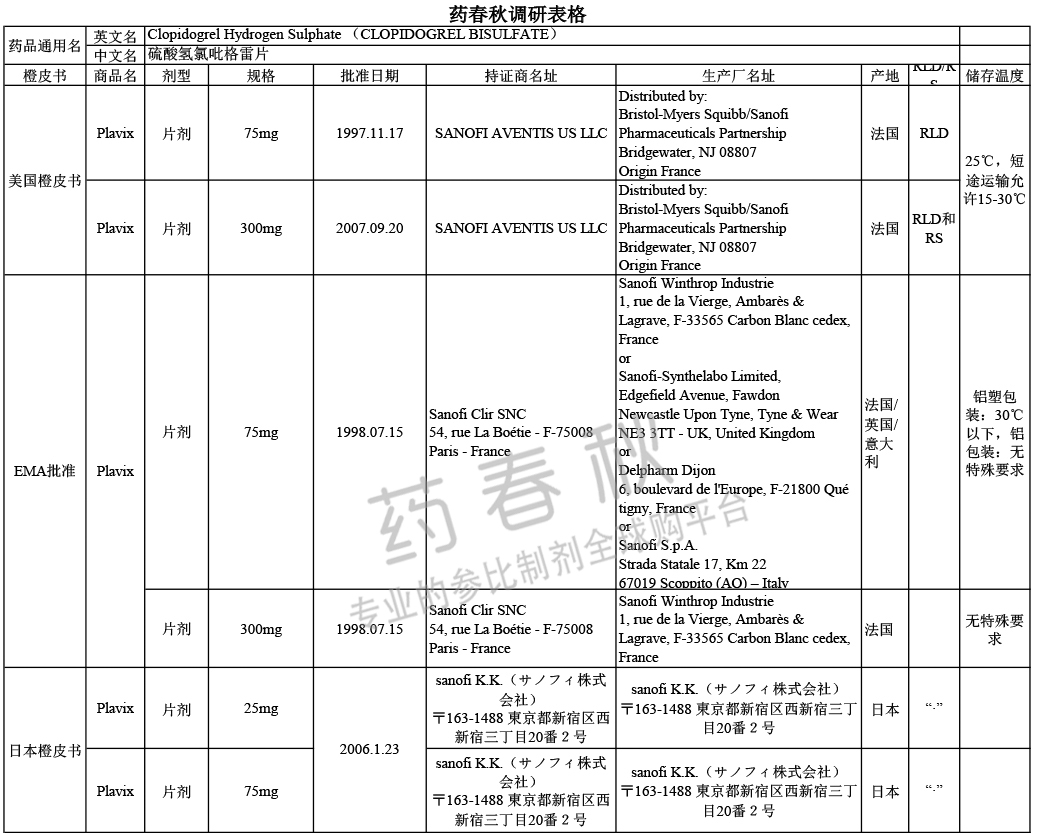
硫酸氢氯吡格雷片原研药在美国和欧盟上市的规格是75mg,300mg,在日本上市规格是25mg,75mg。
CFDA参比目录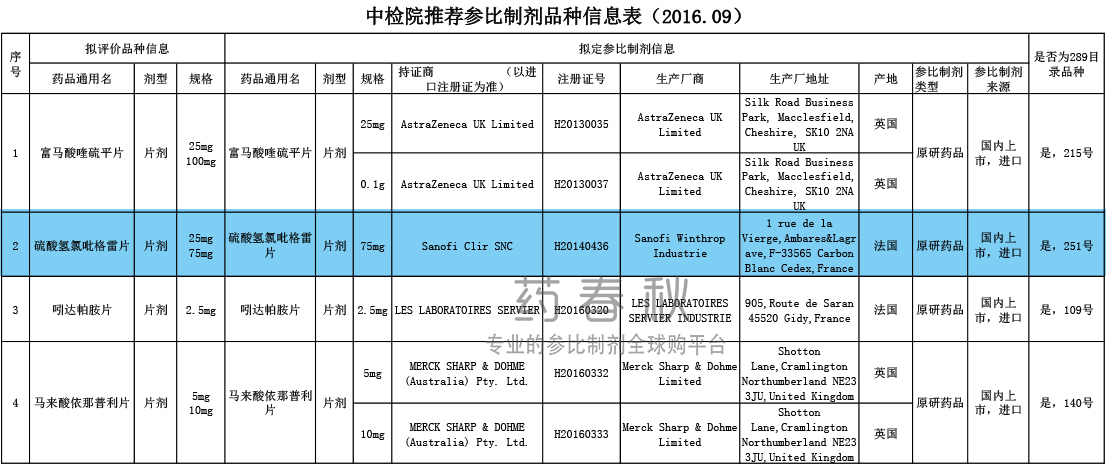
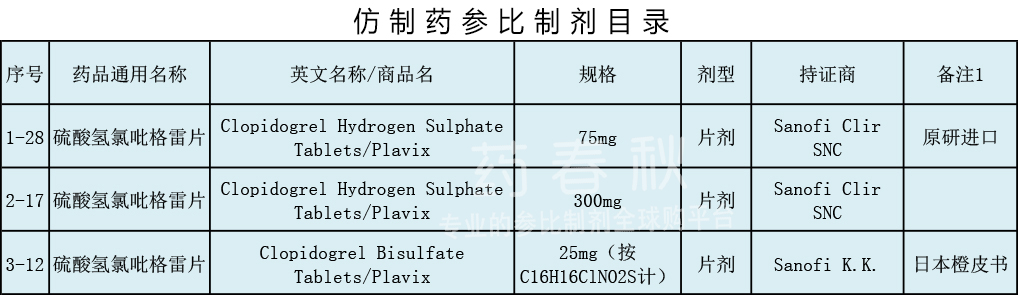
早在2016年中检院推荐参比制剂品种信息表中,硫酸氢氯吡格雷片的拟定参比制剂是Sanofi Clir SNC的产品。
在CFDA仿制药参比制剂第一、二、三批目录中,原研进口的Sanofi Clir SNC75mg和300mg规格被收录;而25mg的规格,则选用日本Sanofi K.K的产品作为参比制剂。
企业参比制剂备案
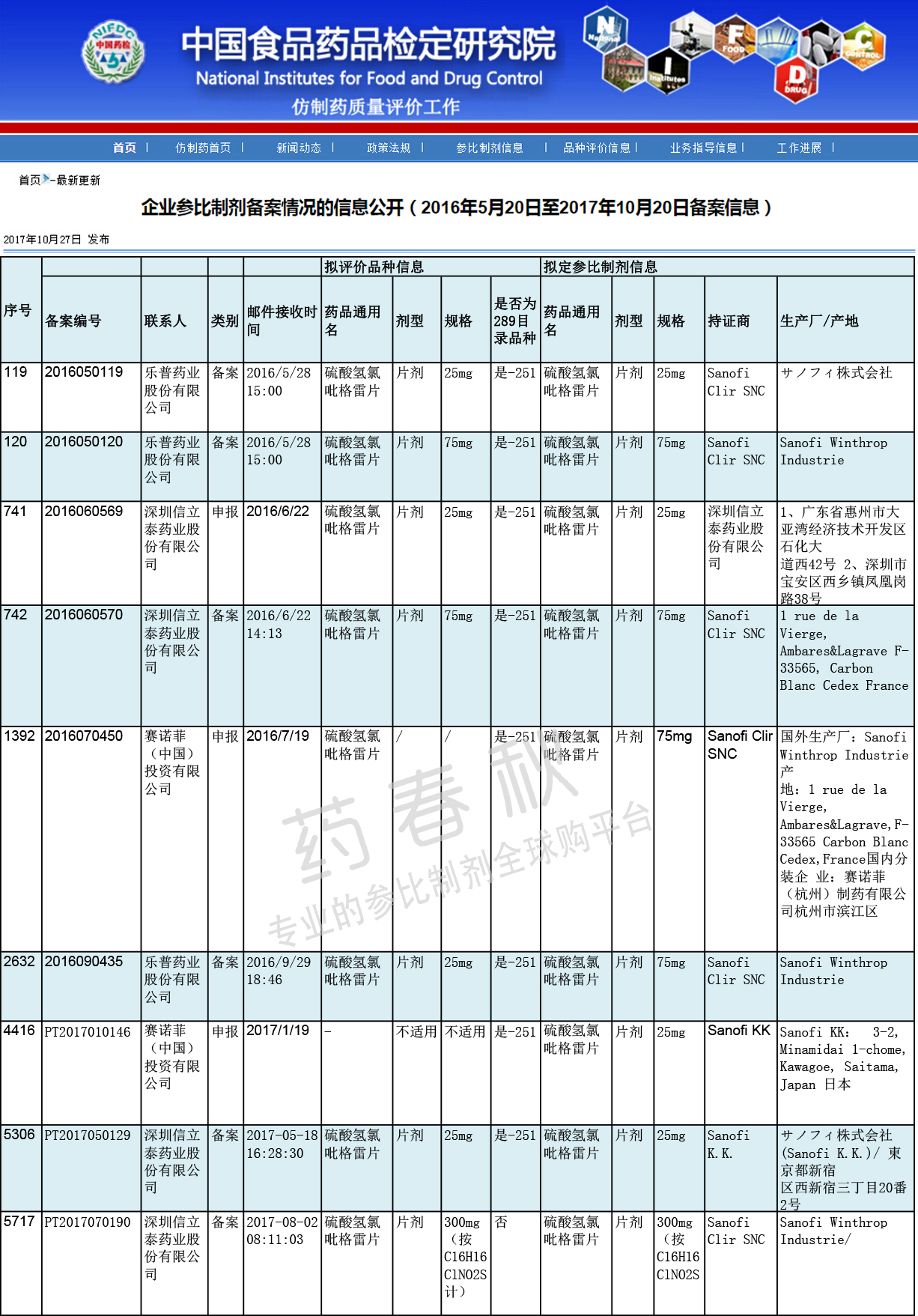
(来源|CDE网站 2017/12/7)
根据中检院公开企业参比制剂备案信息,此产品备案企业只有三家。乐普药业快人一步,最先对25mg,75mg两个规格参比制剂做出选择;信立泰随后,选择与前者不同的参比制剂;赛诺菲申报成为参比制剂。
总体来看,三家企业在75mg、300mg两个规格的参比制剂选择上没有太大分歧,但在25mg规格上则隐隐“较劲”。
究其原因,可以从该产品2016年国内销售数据看出端倪:
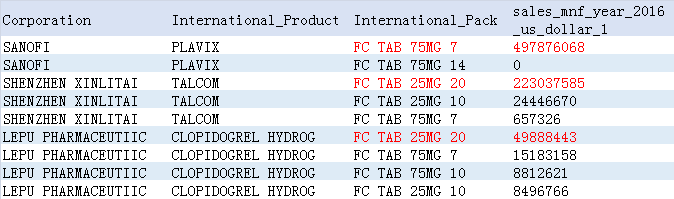
(来源|IMS)
除了原研进口的赛诺菲75mg销量居首位,信立泰和乐普的25mg规格销量均远高于75mg规格。尤其信立泰的氯吡格雷首仿药-泰嘉(25mg),已经成功占据相当一部分的市场份额。因此,信立泰在早期有的放矢申报其25mg规格为参比制剂,如果这一尝试一旦成功,于信立泰而言在一致性评价工作中便取得了里程碑式的胜利。
在随后CFDA第三批参比制剂目录的公告 “把日本赛诺菲的产品选为硫酸氢氯吡格雷片25mg参比制剂”,信立泰药业也顺势而为,对25mg规格重新选择参比制剂备案。
BE备案
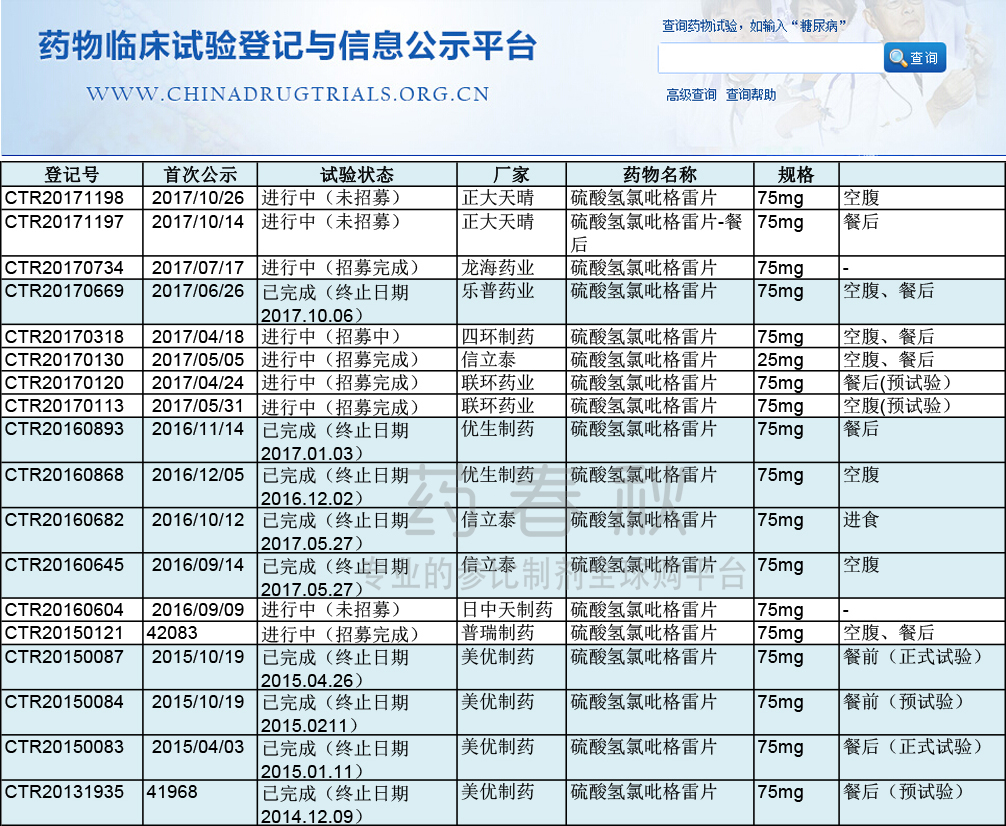
(来源|CDE网站 2017/12/7)
根据CDE网站BE备案信息,信立泰已经完成了75mg的空腹、进食两项BE试验,25mg的BE试验已经完成招募;乐普药业在今年10月也已完成75mg的BE实验,25mg没有BE试验备案。优生制药和美优制药的BE试验也已经完成。
CDE注册申请
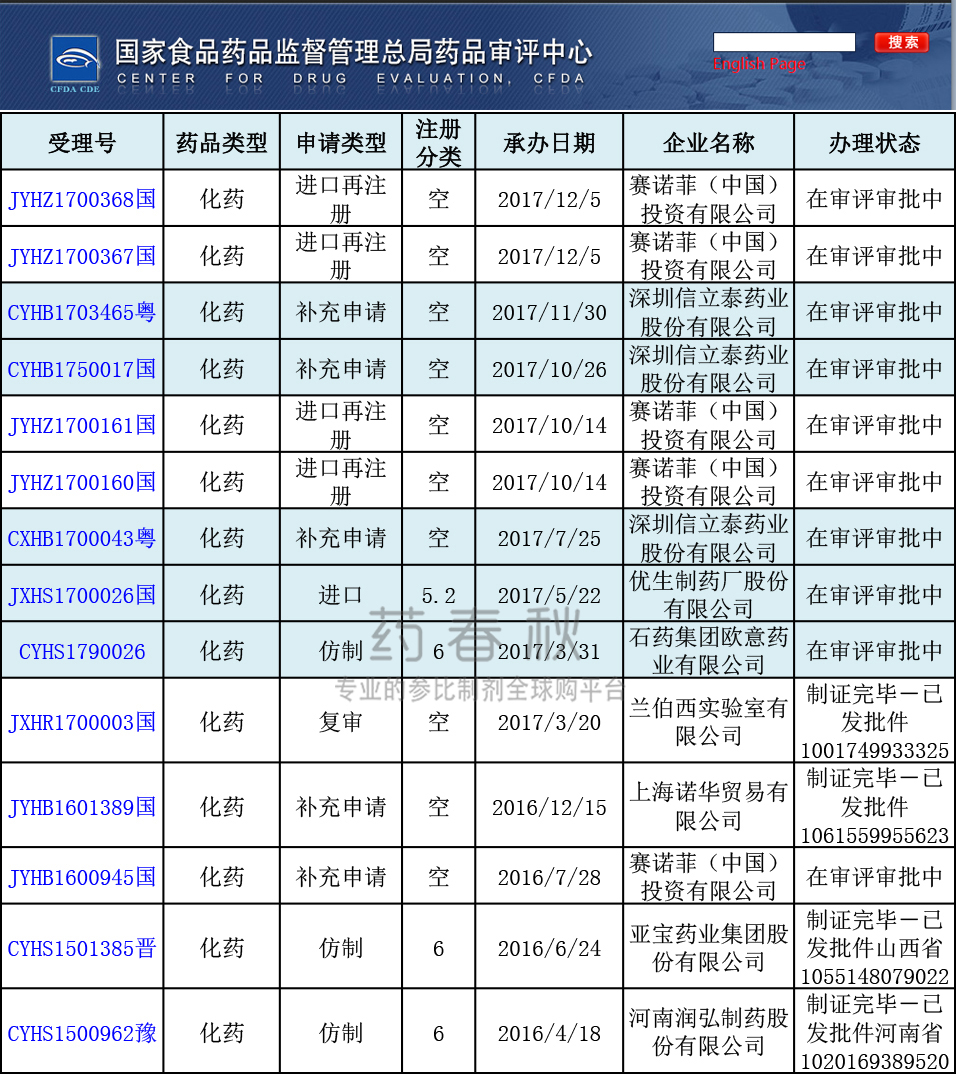
(来源|CDE网站 2017/12/7)
总局药审中心的注册申请数据显示,信立泰、优生制药已排队待审评。石药集团走海外上市回国内申报的路径,且被列入第十八批优先审评名单,审评进度可观。
激烈的冲刺阶段,谁能成为此品种前三家通过一致性评价的企业,值得期待!



