注射剂一致性评价的提出与进程
2016年,国务院办公厅发布了《关于开展仿制药质量和疗效一致性评价的意见》,开始启动仿制药一致性评价工作,口服固体制剂先行,注射剂按兵不动;
2017年10月,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出力争用5~10年时间基本完成对已上市药品注射制剂的再评价工作。这是我国首次在国家层面上提出注射剂需开展仿制药一致性评价;
2017年12月22日国家药监局药品审评中心发布《已上市化学仿制药(注射剂)一致性评价技术要求》征求意见稿,对已上市化药注射剂开展一致性评价做准备。
2018年7月6日,全国药品监管工作座谈会在京召开,国家药监局局长焦红对下半年工作做了具体部署,其中包含“启动药品注射剂再评价工作。”
2019年3月28日,药审中心发布《化学仿制药参比制剂目录(第二十一批)》。此次公布的化药参比目录,共327个品种规格,其中有224个是注射剂参比制剂。这是21批参比制剂目录中,首次出现注射剂参比制剂。
此举是否表示着:注射剂一致性评价已经启动了呢?
尽管无正式文件对注射剂一致性评价“限定品种范围和期限”,可早有一批具先见之明的企业走在评价的路上。
截止目前,CDE承办的超1千条一致性评价申请中,有239条是注射剂一致性评价申请,涉及84个品种。
治疗类别
84个申报品种,要数“全身用抗感染药物”最多,有23个,如:美罗培南、替考拉宁、阿奇霉素、左氧氟沙星等;“血液和造血系统药物”次之,有16个,有依诺肝素钠、比伐卢定、甲钴胺等;接着“抗肿瘤和免疫调节剂”有12个,“神经系统药物”有10个。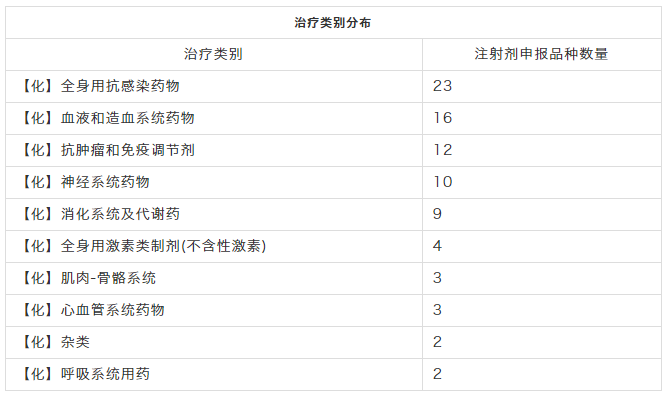
最热门品种
申报热门品种,当属“注射用帕瑞昔布钠”,有5家企业申报;接着是盐酸右美托咪定注射液、注射用硼替佐米、注射用盐酸吉西他滨、注射用培美曲塞二钠,均有4家企业。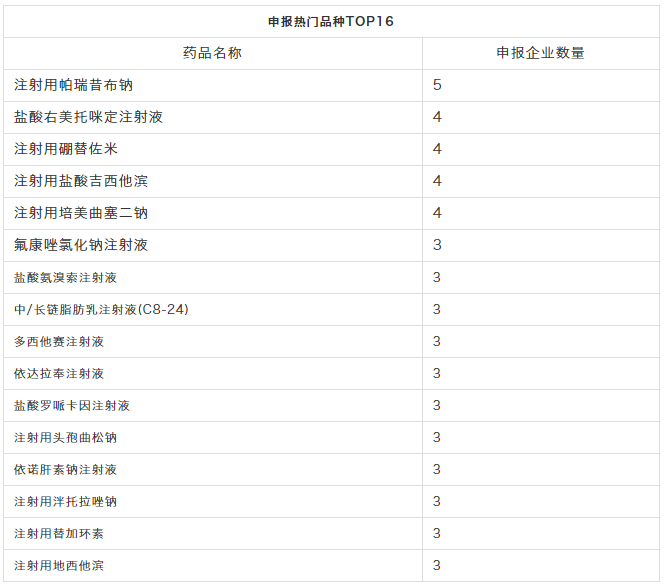
最积极企业
齐鲁制药最为积极,共提交了13个注射剂评价申请;正大天晴药业提交9个品种;
江苏恒瑞、四川科伦、齐鲁制药(海南)均有8个;
湖南科伦、江苏豪森各7个;
接着是宜昌人福、扬子江等。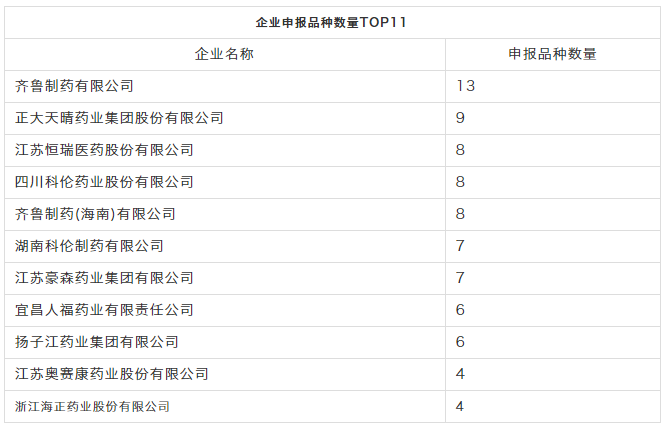
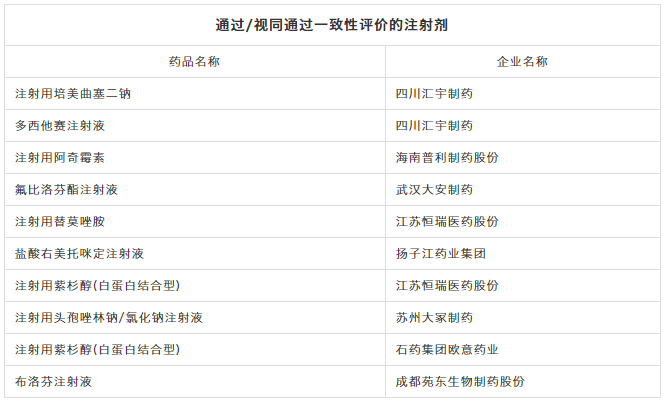
通过一致性评价情况
截止目前,共10个注射剂品种通过/视同通过一致性评价: