纳入CDE优先评审的名单又添新成员。
6月6日,CDE公布第十九批拟纳入优先审评程序药品注册申请的公示,本批共有15个受理号被纳入清单。
根据纳入优先神评审批的范围,春秋君对新名单稍作归纳。

罕见病
1个受理号,为:人凝血酶原复合物,山西康宝生物制品,主要用于治疗先天性和获得性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ缺乏症。
重大专项
1个受理号,为:重组埃博拉病毒病疫苗,康希诺生物,主要用于预防埃博拉病毒。
儿童用药品
2个产品4个受理号,为:康希诺生物的小儿多种维生素注射液(13),和昆泰企业管理的艾塞那肽注射液。
治疗肿瘤
1个受理号,为:瑞戈非尼片,拜耳医药,主要用于治疗结直肠癌、胃肠道间质瘤。
具有明显治疗优势
5个产品8个受理号,为:英创远达的注射用盐酸美法仑,北京汇智泰康医药的盐酸丁丙诺啡纳洛酮舌下片,北京诺华制药的雷珠单抗注射液,艾尔建的地塞米松玻璃体内植入剂,拜耳医药的阿柏西普眼内注射溶液。
第十九批拟纳入优先审评程序药品注册申请公示名单如下:
附:1.优先审评申请审核和公示流程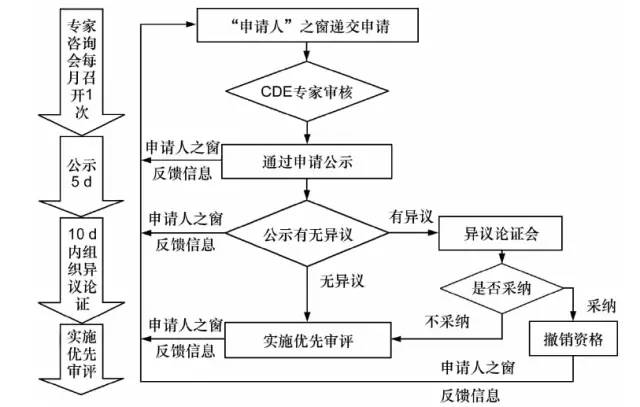
2.《总局关于解决药品注册申请积压实行优先审评审批的意见》中,关于纳入优先审评审批的范围,如下:
(一)具有明显临床价值,符合下列情形之一的药品注册申请:
1.未在中国境内外上市销售的创新药注册申请。
2.转移到中国境内生产的创新药注册申请。
3.使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请。
4.专利到期前3年的药品临床试验申请和专利到期前1年的药品生产申请。
5.申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请;在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请。
6.在重大疾病防治中具有清晰的临床定位的中药(含民族药)注册申请。
7.列入国家科技重大专项或国家重点研发计划的新药注册申请。
(二)防治下列疾病且具有明显临床优势的药品注册申请:
1.艾滋病;
2.肺结核;
3.病毒性肝炎;
4.罕见病;
5.恶性肿瘤;
6.儿童用药品;
7.老年人特有和多发的疾病。
(三)其他
1.在仿制药质量一致性评价中,需改变已批准工艺重新申报的补充申请;
2.列入《关于开展药物临床试验数据自查核查工作的公告》(食品药品监管总局2015年第117号)的自查核查项目,申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请;
3.临床急需、市场短缺的药品注册申请。具体品种名单由国家卫生计生委和工业和信息化部提出,食品药品监管总局药品审评中心组织相关部门和专家论证后确定。



