中检院每期都会公布的信息,乍看没啥特别。
最近被药春秋的调研精神感染,小编也跃跃欲试,摩拳擦掌,硬是要挖掘出某些“亮点”。(若一不小心走上歧路,请小伙伴多多纠正~)
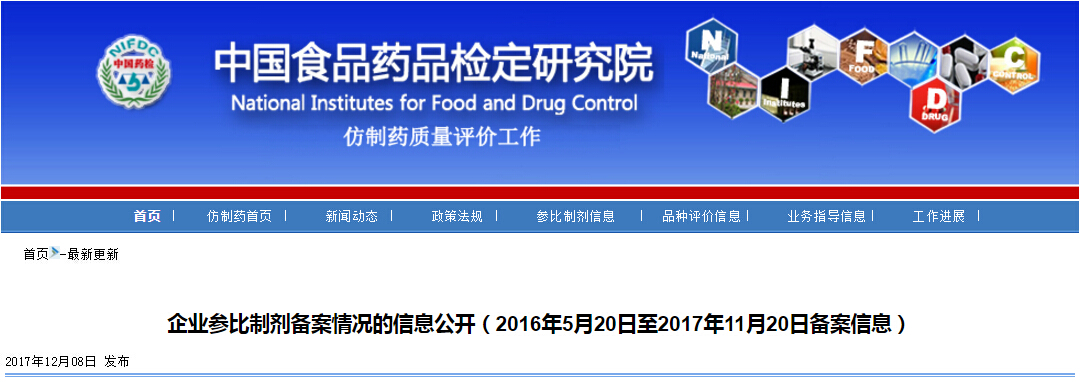
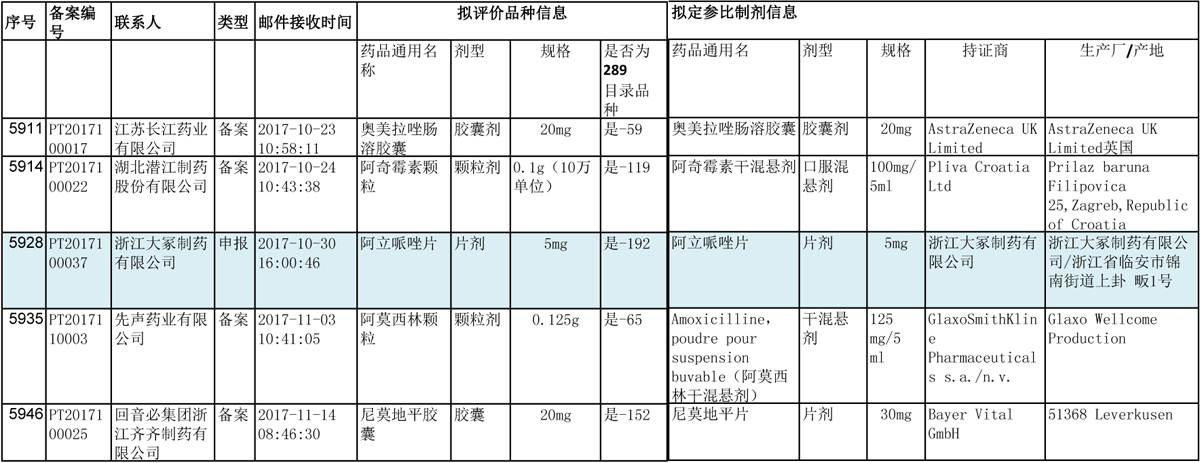
43条备案信息中,备案品种属于289目录的,只有5条信息。拥有289目录品种的企业,到这个时刻,决定开展评价的早已行动,战略放弃的也差不多鸣金收兵了。企业开始向289目录外的品种提前布局一致性评价工作。
(一开始被企业迟疑和观望的一致性评价,现已打得火热,当下虽急,也要提前抢占下一战的先机。)
再看备案信息中自证参比制剂的品种
(类型为“申报”)
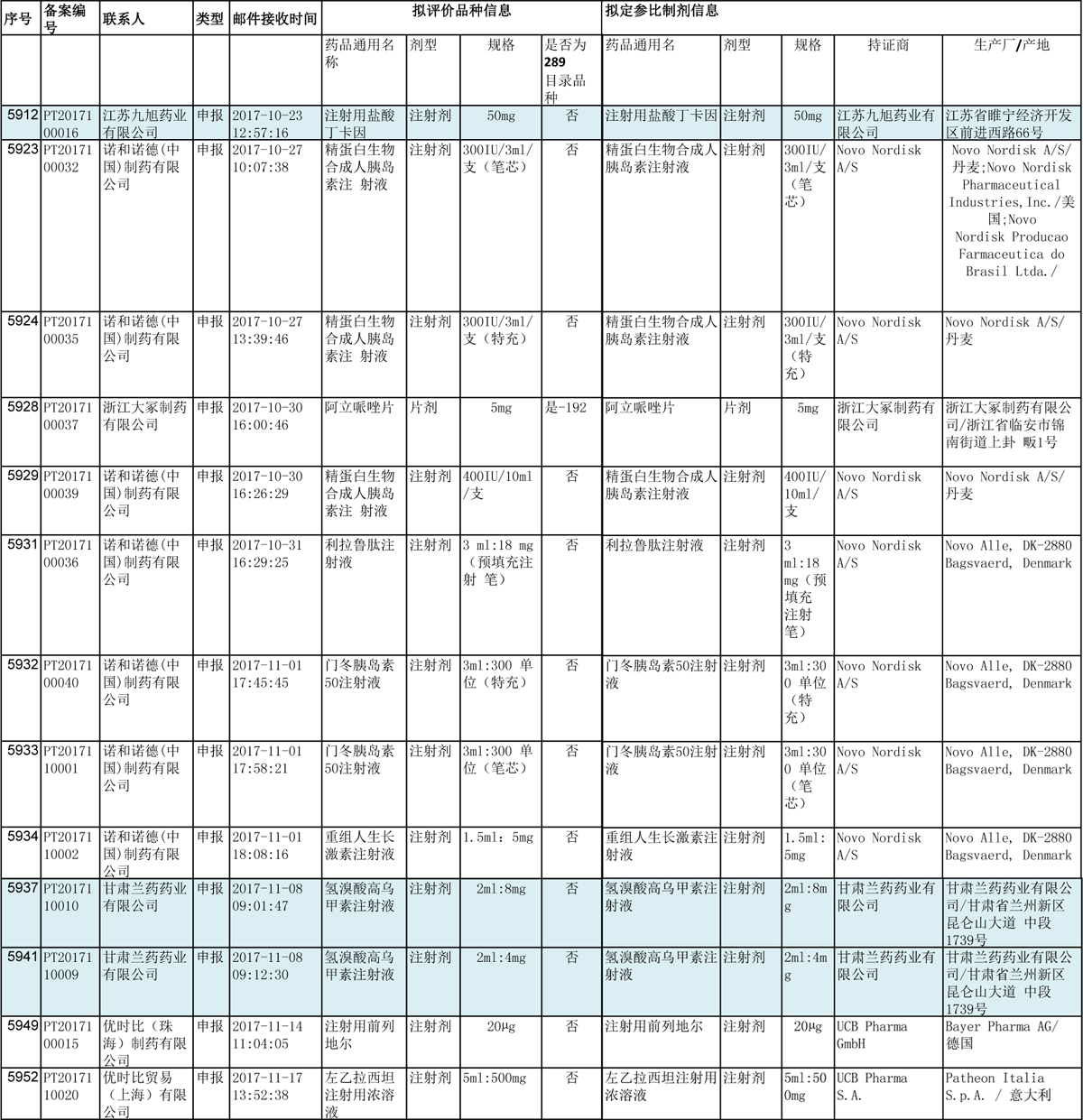
除了浙江大冢的阿立哌唑是片剂,其余均是注射剂。此前,总局已在相关文件中,已提及注射剂的一致性评价。(这也是紧跟政策的明智之举。)
5月11日,总局《关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关政策》(征求意见稿)第三条提出:开展上市注射剂再评价,力争用5至10年左右时间基本完成已上市注射剂再评价工作。
自证参比制剂信息中,国内仿制药有江苏九旭药业的注射用盐酸丁卡因(50mg)(此品种国内批准文号数共12个),和甘肃兰药药业的氢溴酸高乌甲素注射液(2ml:4mg,2ml:8mg)(此品种国内批准文号数共22个)。
仿制药自证参比制剂,很大程度上,也是国内仿制药品牌形象的建立。




