
小编碎碎念
今年,CFDA勇挑重担、夙兴夜寐的劳模形象已深深印在咱们心里,各种“周五重磅、深夜发文、节前大礼包”已是常态。这不?当所有人都觉得首批通过一致性评价品种会在2018年初出炉,CFDA硬是要在2017年底公布,还附送“中国版橙皮书”——《中国上市药品目录集》。(这元旦礼包够大的!)
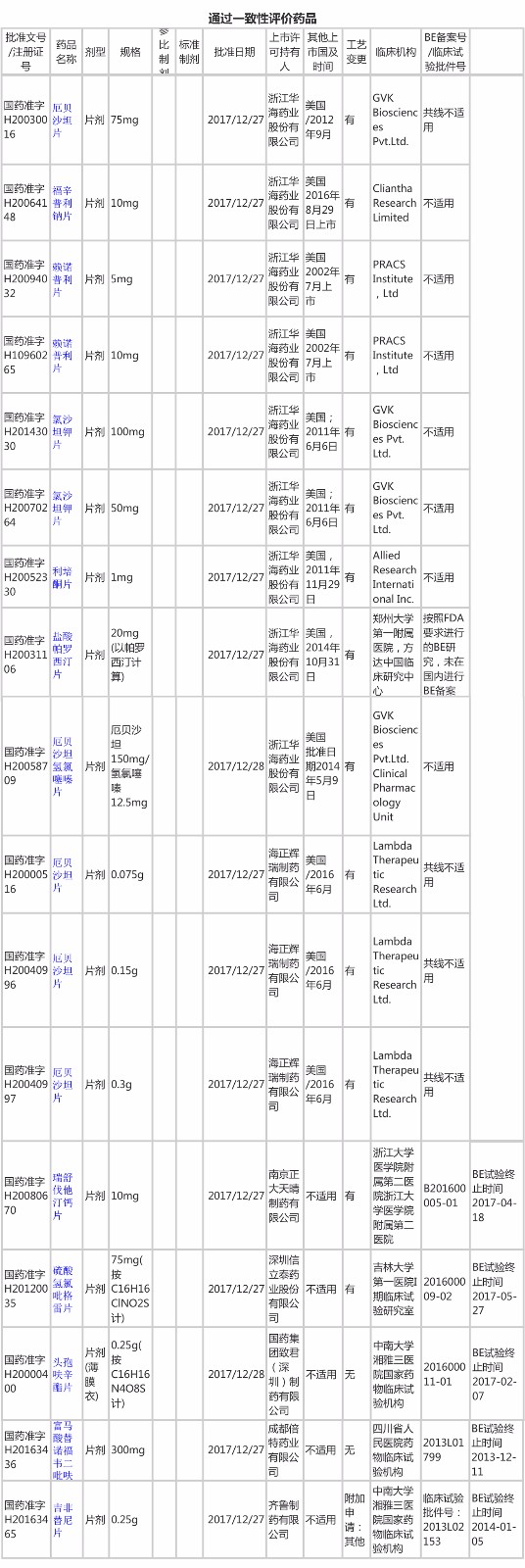
1、通过一致性评价品种
拆开礼包,17个通过一致性评价的品种亮瞎了眼。激烈的一致性评价争位赛,如千军万马过独木桥,能够抢在“首批”过河的,必然身怀绝技。咱们要好好学(tou)习(shi)了。
17个药品,浙江华海的9个品种规格和海正辉瑞的3个品种规格均已在美国上市,根据CFDA2017年第100号文,在欧盟、美国或日本批准上市的仿制药已在中国上市并采用同一生产线同一处方工艺生产的,申请人提交境外上市申报的生物等效性研究、药学研究数据等技术资料,审评通过后,视同通过一致性评价。华海药业的通过一致性评价的品种主要是心血管和精神科的药品,此举更大大推进其在该领域的布局。
从华海和海正辉瑞的临床机构看,GVK、Cliantha、Lambda均是印度公司,CFDA认同印度做的BE数据。(如果不是特殊品种,种族差异的问题,似乎也非必做项目。有ANDA批文的企业可以效仿。)
另外5个品种,则是依足CFDA要求从BE到申报一步一脚印,而结果也不亏待老实人。这几个产品本身在该品种市场中就占一定的份额,率先开展并通过一致性评价,借此机拉开与国内竞争对手的距离,拉近与原研的差距,果断且自信!
2、原研进口药品

药品目录集目前共收录203个品种规格,数量最多的当数进口原研药品,172个。此类别需结合上市状况做筛选,暂停销售的41个品规都是浮云,买到参比才是硬道理。
买不到的原研进口药品,只能寻找国外上市的原研药了。
3、国内创新药
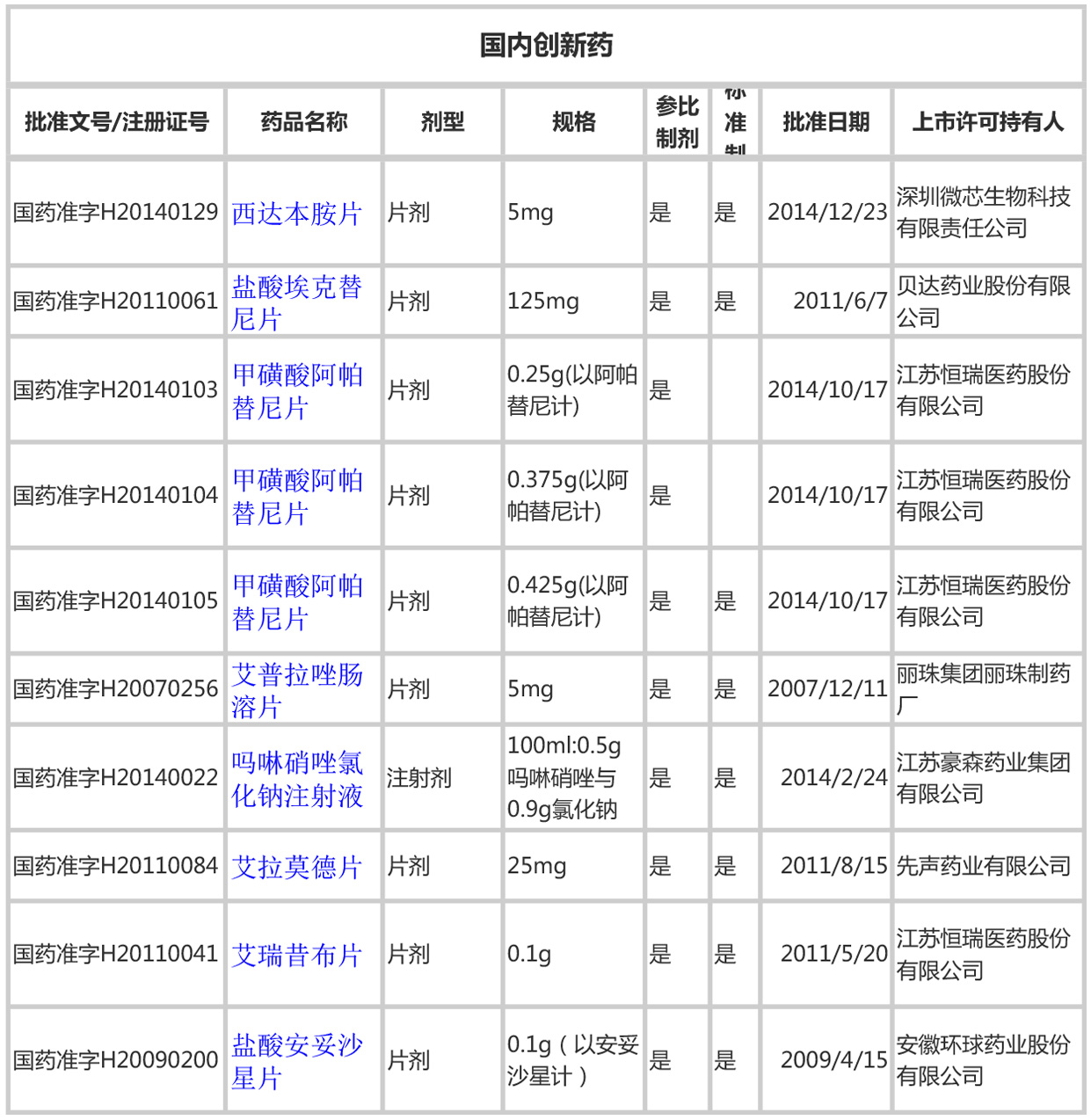
国内创新药有11个品规,自然也被列为参比制剂。
参比制剂(RLD)和标准制剂(RS)含义源自美国橙皮书。
(参比制剂(Reference Listed Drug,简称RLD)是指在我国批准上市,用于仿制药注册申请的参照药品。通常是具有完整规范的安全性和有效性研究数据的药品。
标准制剂(Reference Standard,简称RS)是指在我国批准上市,用于人体生物等效性研究的对照药品。通常最大规格的参比制剂被确定为标准制剂,如果最大规格在健康受试者中存在安全隐患或其他原因,可指定其他规格的参比制剂为标准制剂。为保证标准制剂的可获得性,必要时可指定新的标准制剂。)
4、按新注册分类批准、其他
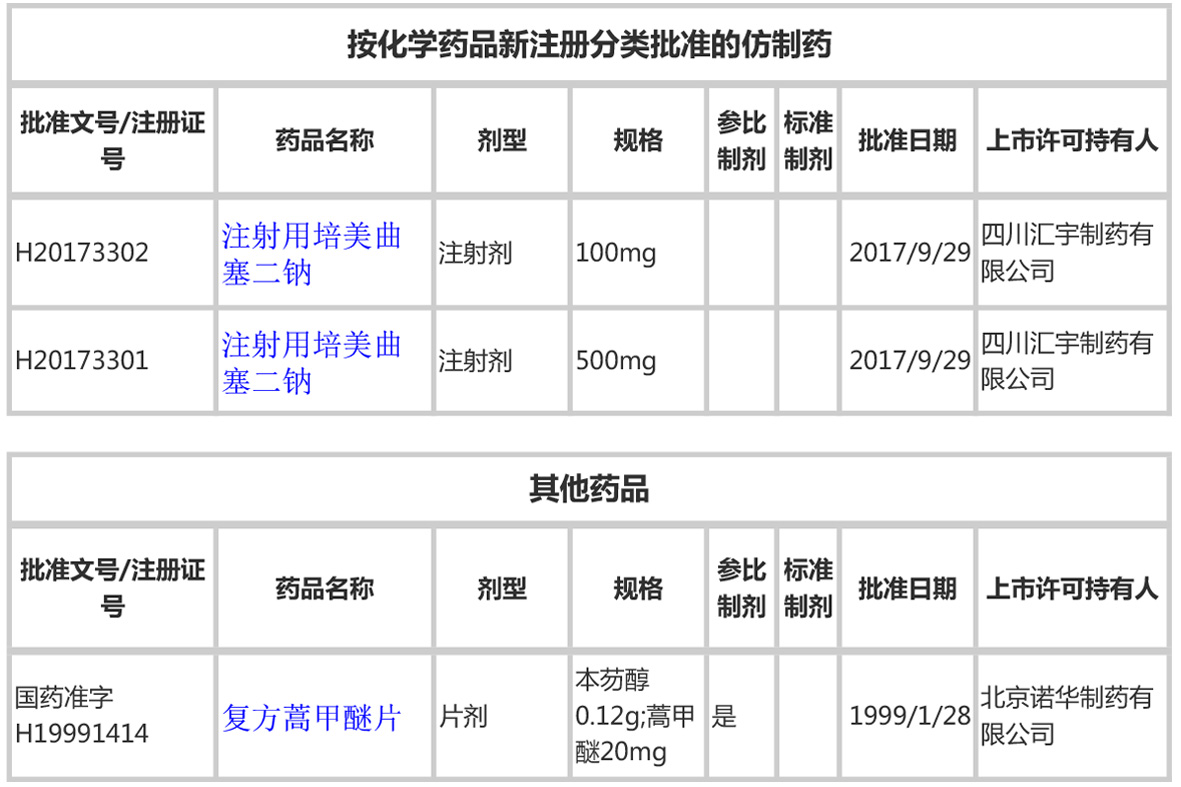
按化学药品新注册分类批准的仿制药,同时也被视为通过一致性评价,有1个品种两个品规。
属于“其他药品”类别的,有1个品种规格。
其他疑问
问丨何谓TE代码?
答丨据目录集的使用指南:TE代码即治疗等效性评价代码(Therapeutic Equivalence Evaluations Code)。
TE代码的首字母A或B分别代表两个类别
A:与其他药学等效药品具有治疗等效性的药品;通过充分的体内和/或体外研究数据证明生物等效的药品,标识为AB;
B:目前认为与其他药学等效药品不具有治疗等效性。
至此,便是203个被收录在《中国上市药品目录集》的药品。《中国上市药品目录集》吸取了美国橙皮书的优点,并加入药品的专利信息、说明书、审评报告、BE研究等公开信息,信息集中方便查询,青出于蓝而胜于蓝,点赞!
一致性评价最新资讯、参比制剂采购咨询,尽在 “药春秋”




