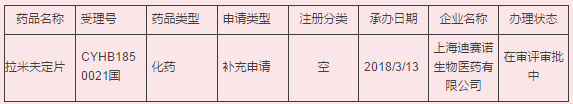
最新:3月13日,上海迪赛诺生物医药有限公司的拉米夫定片提交了一致性评价补充申请,是该品种首家提交一致性评价的企业。
(咋看没毛病啊,看完销售数据后,不得不给它点个赞!)
拉米夫定是核苷类化合物,属于全身用抗病毒药,是第一个用于抗乙型肝炎病毒(HBV)的核苷类似物,适用于丙氨酸氨基转移酶(ALT)升高并有病毒活动复制的慢性乙型肝炎患者。
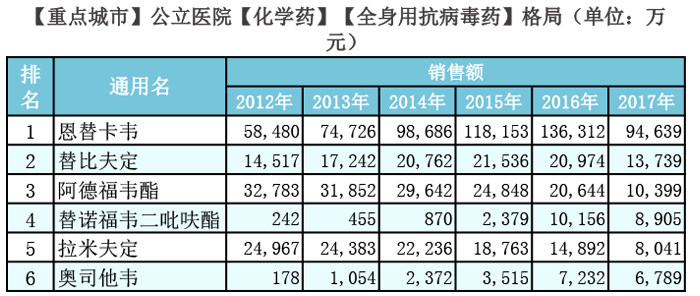
重点城市公立医院销售数据
全身用抗病毒药类目中,2017前三季度销售额,拉米夫定排在第五位,约8千万元,对比往年的销售数据,呈逐年现降趋势。(前四位分别是:恩替卡韦、替比夫定、阿德福韦酯、替诺福韦二吡呋酯。)
(2017年仅统计到前三季度)
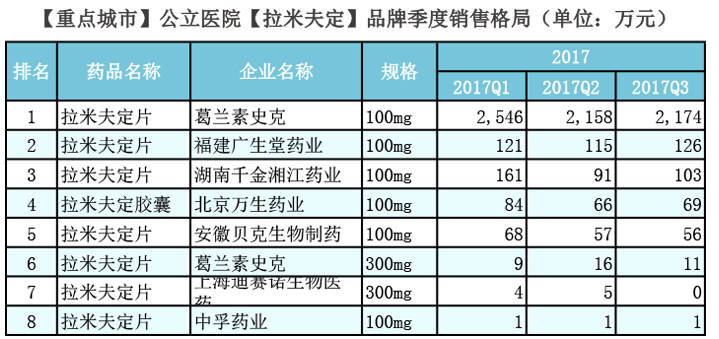
拉米夫定各品牌的销售也呈下降趋势,排名第一的原研葛兰素史克(市场份额85.9%),从2012年的2.4亿元降至2016年1.29亿元;排名第二、三的分别是福建广生堂药业(市场份额4.49%)和湖南千金湘江药业(市场份额4.41%),2017年前三季度销售分别为361万和355万。上海迪赛诺生物医药,2017年前三季度销售仅为9万元。
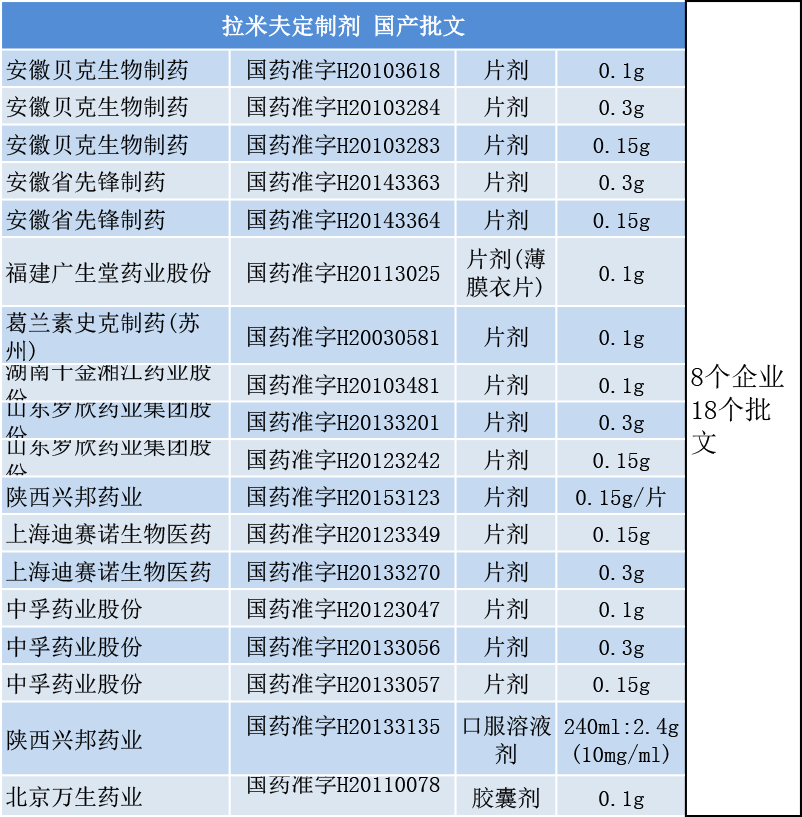
整体来看,拉米夫定是个不太乐观的老品种。1995年于美国获批上市,目前国内仿制药批文:原料药12个,片剂16个,口服溶液1个,胶囊1个。按2016年的销售数据,仿制药总销售额约2千万。(讲真,此销售数据不足以打动企业投入大成本对该品种开展的一致性评价工作。)
而近日上海迪赛诺生物医药对此品种首先提交一致性评价,真有些意外。迪赛诺生物医药的市场份额极低,只有0.11%,2016年销售仅为40万元。何以支撑它提交一致性评价呢?
时间关卡:拉米夫定属于289目录品种,按规定需在2018年底前完成一致性评价,如今时间所剩无几,现在起步说不准能否来得及,这必定淘汰一大片仿制药,危险与机遇共存;
BE或可豁免:据2017年11月CDE征求的《可豁免或简化人体生物等效性试验(BE)品种》意见稿,拉米夫定属于BCSⅢ类药物,是豁免BE品种,拟处理办法是:采用药学方法评价一致性,企业自证BCS1或3类,根据《人体生物等效性豁免指导原则》提交溶解度、渗透性、溶出度等相关研究资料。(虽然未看到正式稿,但有机会能够跳过BE这个不小的拦路虎,将大大有利于评价工作。)CDE临床试验登记平台显示,迪赛诺生物医药的BE试验在2011年已完成,如果研究资料满足要求,那它的一致性评价工作也是顺势而为,省去很大的力气。
疗程较长:拉米夫定通过直接抑制乙型肝炎病毒 DNA的复制,可使其在1~2个月内开始下降或转阴,随着时间延长,阴转率逐渐提高。它是抑制而非杀灭病毒,故疗程较长,需要2年或以上,品牌粘性较高。
如此看来,拉米夫定的机会就存在于一致性评价这独木桥上,其他竞争者是否也抱着同样的想法呢。
长春海悦药业于2016年完成BE实验,2017年12月已注册分类4类提交上市申请,排队待审评中;
湖南千金湘江药业于2017年3月已登记开展BE实验;
湖南天地恒一制药于2017年7月已完成,未提交注册申请。

为数不多的对手竞争着为数不多的市场份额,唯有通过一致性评价与原研争市场份额,才有出路。故本品开展一致性评价工作,还需慎重考虑。



