自2016年3月4日实施《化学药品注册分类改革工作方案》以来,CFDA对政策解读已出3个。现整理如下,供大家查询参考。
化学药品注册分类改革工作方案
2016.03.04
一、调整化学药品注册分类类别
对化学药品注册分类类别进行调整,化学药品新注册分类共分为5个类别,具体如下:
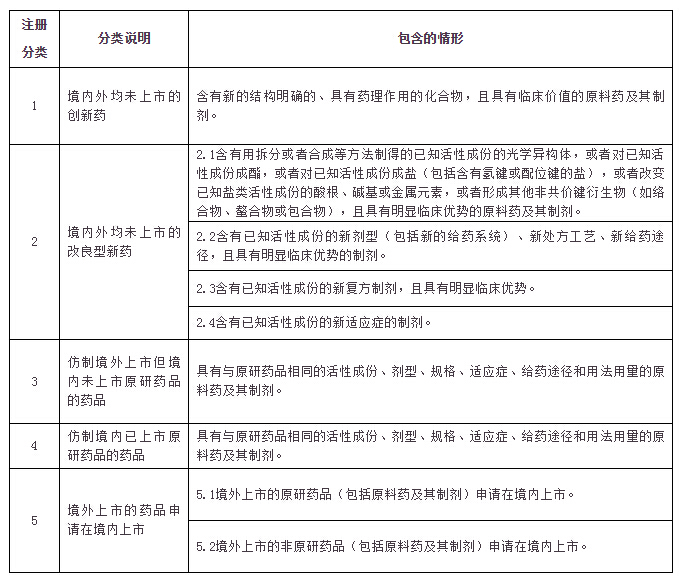
注:1.“已知活性成份”指“已上市药品的活性成份”。
2.注册分类2.3中不包括“含有未知活性成份的新复方制剂”。
二、相关注册管理要求
(一)对新药的审评审批,在物质基础原创性和新颖性基础上,强调临床价值的要求,其中改良型新药要求比改良前具有明显的临床优势。
对仿制药的审评审批,强调与原研药品质量和疗效的一致。
(二)新注册分类1、2类别药品,按照《药品注册管理办法》中新药的程序申报;
新注册分类3、4类别药品,按照《药品注册管理办法》中仿制药的程序申报;
新注册分类5类别药品,按照《药品注册管理办法》中进口药品的程序申报。
新注册分类2类别的药品,同时符合多个情形要求的,须在申请表中一并予以列明。
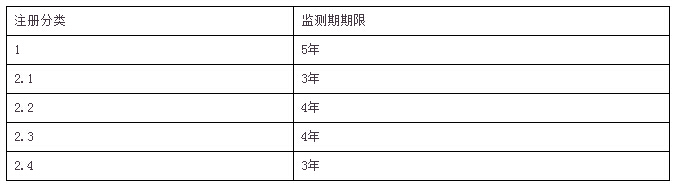
(三)根据《中华人民共和国药品管理法实施条例》的有关要求,对新药设立3—5年监测期,具体如下:
化学药品新药监测期期限表
(四)本方案发布实施前已受理的化学药品注册申请,可以继续按照原规定进行审评审批,也可以申请按照新注册分类进行审评审批。
如申请按照新注册分类进行审评审批,补交相关费用后,不再补交技术资料,国家食品药品监督管理总局药品审评中心要设立绿色通道,加快审评审批。符合要求的,批准上市;不符合要求的,不再要求补充资料,直接不予批准。
(五)新注册分类的注册申请所核发的药品批准文号(进口药品注册证/医药产品注册证)效力与原注册分类的注册申请核发的药品批准文号(进口药品注册证/医药产品注册证)效力等同。
(六)国家食品药品监督管理总局组织相关部门细化工作要求,做好受理、核查检查、技术审评及制定、修订相关国家药品标准等工作。
(七)《药品注册管理办法》与本方案不一致的,按照本方案要求执行。
《化学药品注册分类改革工作方案》政策解读(三)
2017.05.31
一、化学药品新注册分类申报资料要求的《原料药药学信息汇总表》《制剂药学信息汇总表》《非临床研究信息汇总表》《临床信息汇总表》填报时格式、目录及项目编号能否进行修改?
答:2016年5月4日,《总局关于发布化学药品新注册分类申报资料要求(试行)的通告》(2016年第80号),附件《化学药品新注册分类申报资料要求(试行)》中申报资料撰写说明,信息汇总表中的信息是基于申报资料的抽提,各项内容和数据应与申报资料保持一致,并在各项下注明所对应申报资料的项目及页码。主要研究信息汇总表的格式、目录及项目编号不能改变。即使对应项目无相关信息或研究资料,项目编号和名称也应保留,可在项下注明“无相关研究内容”或“不适用”。对于以附件形式提交的资料,应在相应项下注明“参见附件(注明申报资料的页码)”。
二、药品申报资料中临床试验报告的封面有哪些要求?
答:依据《总局关于发布化学药品新注册分类申报资料要求(试行)的通告》(2016年第80号),临床试验报告参照《化学药物临床试验报告的结构与内容技术指导原则》,该指导原则要求临床试验封面应包括受试药物通用名、研究类型、研究编号、研究开始日期、研究完成日期、主要研究者(签名)、研究单位(组长)(盖章)、统计学负责人签名及单位盖章、药品注册申请人(盖章)、注册申请人的联系人及联系方式、报告日期、原始资料保存地点。同时,按照《关于印发化学药药学资料CTD格式电子文档标准(试行)和药品注册申报资料的体例与整理规范的通知》(食药监办注〔2011〕98号)附件2要求,临床试验报告封面应加盖临床研究基地有效公章,印章应加盖在文字处,并符合国家有关用章规定,具有法律效力。
三、如何办理化学药品新注册分类费用的补交或退还?
答:关于补交方式。申请人须按照《关于化学药品新注册分类收费标准有关事宜的通告》(2016年第124号)中,提交补交费用申请及相关材料至原受理部门,由原受理部门开具“行政许可事项缴费通知书(补交)”,申请人持缴费通知书办理缴费。
关于退还方式。申请人须按照《关于化学药品新注册分类收费标准有关事宜的通告》(2016年第124号),提交补交费用申请及相关材料至原受理部门,原受理部门按照“全款方式”即先补交全款的费用,再办理与其相对应费用的退还。
四、对于BE过程中处方工艺有变动的是否可在总局药审中心网站BE试验备案平台上备案?
答:BE试验过程中,参比制剂、原料药、制剂处方、工艺等发生变更,注册申请人可通过备案平台如实备案,申报生产时,在申报资料中一并提交历次变更及备案资料。
五、研发机构在新注册分类发布前已基本完成研发的原注册分类第3类产品如何注册申报?
答:《药品注册管理办法》第七十三条规定,仿制药申请人应当是药品生产企业。《关于发布化学药品注册分类改革工作方案的公告》规定,新注册分类3、4类别药品应按仿制药的程序申报。考虑到部分研发机构在新注册分类发布前已基本完成原注册分类第3类产品的研发,对于此类情形,若研发机构仍希望继续申报的,可向省局提出书面申请,经省局确认,如确属在新分类工作方案发布前完成相关研究工作,并需要开展临床试验的,可按新注册分类和仿制药的程序受理。
研发机构位于药品上市许可持有人试点行政区域内的,申请人应按照持有人试点方案要求进行申报。
《化学药品注册分类改革工作方案》政策解读(二)
2016.12.15
《化学药品注册分类改革工作方案》解读(一)
2016.03.16



